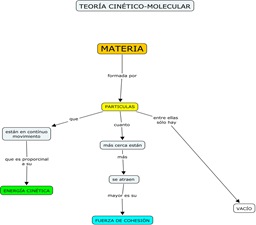
Mediante los siguientes links podrás acceder a diversos cuadros, simulaciones y animaciones referidas a las principales leyes que iremos desarrollando en clase respecto de este tema.
1. Estados de agregación de la materia: sólido , líquido, gaseoso. (cada ejemplo corresponde a una sustancia distinta).
2. Cambios de estado.
3. Temperatura. y Temperatura 2 . Escalas Celsius (ºC), Fahrenheit (ºF) y Absoluta (ºK).
4. Presión. (en general) y presión de un gas Ver sobre todo el simulador.(las fórmulas que siguen, no)
5. Volumen.
6. Mol . Masa molar. Número de Avogadro.
7. Ley de Avogadro. : El volumen de cualquier gas es directamente proporcional a la cantidad de moles de ese gas. Es decir que : volúmenes iguales de distintos gases (o del mismo gas, por supuesto), medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moles y de moléculas.(sólo importa la cantidad de moléculas y no cómo son esas noléculas)
8. Ley de Boyle - Mariotte : La presión de una determinada masa de un gas en un recipiente cerrado es ...................................proporcional a su volumen ( = volumen del recipiente que lo contiene) , cuando la temperatura se mantiene constante.(procesos isotérmicos).
9. Ley de Charles : El volumen de una determinada masa de un gas es ..............................proporcional a su temperatura cuando la presión se mantiene constante (procesos isobáricos)
10. Ley de Gay - Lussac : La presión de una determinada masa de un gas es ..............................proporcional a su temperatura cuando el volumen se mantiene constante (procesos isocóricos)(esperar que encienda el mechero... )
11. Ecuación de Estado de los Gases Ideales.
(en clase estudiaremos las ecuaciones en ese orden).