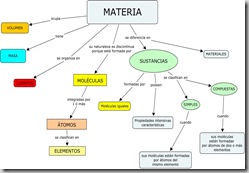
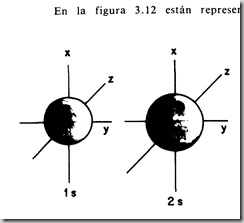
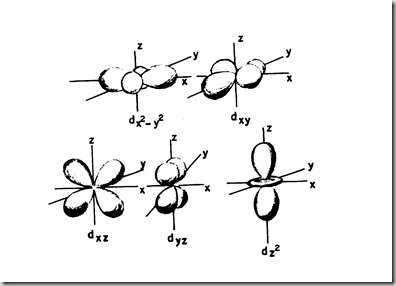
Interesa analizar las características microscópicas de la materia en cada estado de agregación:
2. En otras de las pestañas se presentan los sucesivos cambios de estado, desde el estado sólido hasta llegar al gaseoso. ¿Qué sucede con la temperatura durante los cambios de estado?
3. Realice la actividad integradora.("Actividades finales") que aparece en la última pestaña.
4. Observe la relación entre las animaciones y los postulados de la Teoría cinético-molecular general
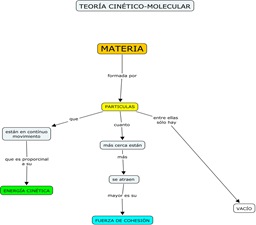
y la TCM aplicada a los gases :

Oportunamente se hará un actividad de cierre.