En esta nota del diario Tiempo Argentino podrán informarse al respecto.
¿Por qué es importante el hallazgo de agua?
viernes, 22 de octubre de 2010
lunes, 18 de octubre de 2010
4º - La Ecuación general y las mezclas de gases (36)

En este mapa conceptual se relacionan las variables que integran la ecuación general aplicada a una mezcla de gases.
sábado, 16 de octubre de 2010
4º - Ecuación General de los Gases ideales (34)

En este mapa conceptual se muestra la ecuación general de los gases y cómo se relacionan las variables que la integran.
miércoles, 13 de octubre de 2010
4º - Problemas con la Ecuación General de los gases ideales (gases puros o mezclas)
Aquí va la prometida serie de problemas (serie 4)sobre mezclas de gases y Ecuación general de los gases ideales, aplicada a un gas solo o a mezclas.
Aquí va una nueva serie (sobre mezclas): PROBLEMAS SERIE 5
(figuran las respuestas)
Aquí va una nueva serie (sobre mezclas): PROBLEMAS SERIE 5
(figuran las respuestas)
miércoles, 6 de octubre de 2010
Polaridad de las sustancias moleculares
El siguiente es un algoritmo para determinar la polaridad de sustancias moleculares relativamente pequeñas.
Si clickean en el mapa conceptual, se abrirá un imagen más grande del mismo.
Lo pueden imprimir y consultar durante la próxima evaluación.
Si clickean en el mapa conceptual, se abrirá un imagen más grande del mismo.
Lo pueden imprimir y consultar durante la próxima evaluación.
martes, 21 de septiembre de 2010
lunes, 28 de junio de 2010
3° - Orbitales y sus formas
En estas figuras podemos apreciar la forma de los orbitales s, p y d.
a) Orbitales s
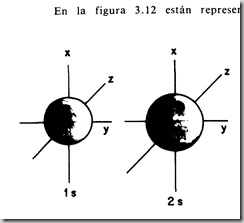
El orbital 2s es más grande y envuelve por fuera al 1s.
b) Orbitales p:
Se observan los tres orbitales p posibles con sus respectivas oreintaciones a lo largo de los ejes x, y y z.

En la siguiente figura, dos orbitales px; el más grande (3px, ubicado en el subnivel 3, nivel 3) envuelve al del nivel inferior (2px, perteneciente al subnivel 2p, nivel 2):

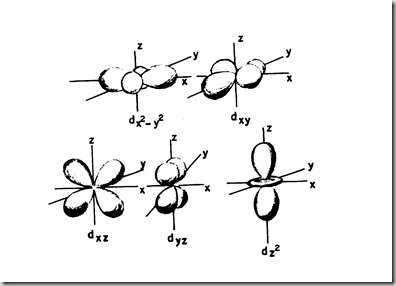
c) Los orbitales d presentan varios lóbulos, lo que les permite adoptar 5 orientaciones posibles.
Debajo de cada uno figura su nombre, pero nosotros nospusimos de acuerdo en llamarlos a todos simplemen te "d"
a) Orbitales s

El orbital 2s es más grande y envuelve por fuera al 1s.
b) Orbitales p:
Se observan los tres orbitales p posibles con sus respectivas oreintaciones a lo largo de los ejes x, y y z.

En la siguiente figura, dos orbitales px; el más grande (3px, ubicado en el subnivel 3, nivel 3) envuelve al del nivel inferior (2px, perteneciente al subnivel 2p, nivel 2):

c) Los orbitales d presentan varios lóbulos, lo que les permite adoptar 5 orientaciones posibles.
Debajo de cada uno figura su nombre, pero nosotros nospusimos de acuerdo en llamarlos a todos simplemen te "d"

3º - Configuración electrónica resumida
Orden en que se van llenado los subniveles de energía, según este Diagrama de Pauling animado. (éste va de abajo hacia arriba y no de arriba hacia abajo como el visto en clase y en la Tabla Periódica)
Aquí abajo se puede apreciar cómo se va completando la configuración electrónica completa de elementos de bajo Z, poniéndose de manifiesto la Regla de Hund y cómo los electrones van ocupando subniveles de energía creciente.
Aquí abajo se puede apreciar cómo se va completando la configuración electrónica completa de elementos de bajo Z, poniéndose de manifiesto la Regla de Hund y cómo los electrones van ocupando subniveles de energía creciente.
miércoles, 23 de junio de 2010
4° - Obtención de Oxosales y Sales Binarias - Nomenclaturas
Etiquetas:
4º,
4º-Estudio,
Hidrácidos,
Hidruros,
Número de oxidación,
Oxácidos,
Sales binarias
lunes, 24 de mayo de 2010
4º - Obtención de óxidos ácidos: algunos aspectos
Observemos la ecuación correspondiente a la obtención del óxido clórico:
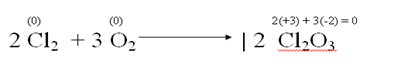
1. El cloro y el oxígeno tienen atomicidad 2 porque sus respectivas moléculas están formadas por dos átomos de cloro y de oxígeno.
2. Las sustancias simples tiene número de oxidación = 0
3. El cloro se oxida porque su número de oxidación aumenta de 0 a +3.
4. El oxígeno se reduce porque su número de oxidación disminuye de 0 a -2.
5. Por estas razones, las reacciones de obtención de óxidos son oxidorreducciones o reacciones rédox.

1. El cloro y el oxígeno tienen atomicidad 2 porque sus respectivas moléculas están formadas por dos átomos de cloro y de oxígeno.
2. Las sustancias simples tiene número de oxidación = 0
3. El cloro se oxida porque su número de oxidación aumenta de 0 a +3.
4. El oxígeno se reduce porque su número de oxidación disminuye de 0 a -2.
5. Por estas razones, las reacciones de obtención de óxidos son oxidorreducciones o reacciones rédox.
Etiquetas:
4º,
4º-Estudio,
Esquemas,
Formulación,
Número de oxidación,
Óxidos,
Rédox
sábado, 15 de mayo de 2010
4º - Números de Oxidación 1
En este cuadro, encontrarán con qué números de oxidación actúan los diversos elementos en las funciones químicas vistas hasta ahora. Es un cuadro integrador. Recomiendo que lo encaren en este sentido y no para "estudiarse de memoria" todos los Nox.
Etiquetas:
4º,
4º-Estudio,
Formulación,
Hidróxidos,
Hidruros,
Nomenclatura,
Número de oxidación,
Oxácidos,
Óxidos,
Rédox,
Tablas
viernes, 14 de mayo de 2010
4º - Fórmulas generales de la funciones químicas
Función química | Fórmula general | Ejemplo |
OXIDO BASICO | MaOb | Fe2O3 |
OXIDO ACIDO | NaOb | Cl2O3 |
OXACIDO | HaNbOc | HClO2 |
HIDROXIDO | M(OH)n | Fe(OH)3 |
HIDRURO METALICO | MHn | FeH3 |
HIDRURO NO METALICO o HIDRACIDO | HnN | HCl |
El cloro, con Nox = +3 en el óxido ácido y en el oxácido y con
Nox = -1 en el hidrácido.
Etiquetas:
4º,
4º-Estudio,
Formulación,
Hidróxidos,
Hidruros,
Nomenclatura,
Número de oxidación,
Oxácidos,
Óxidos,
Tablas
jueves, 1 de abril de 2010
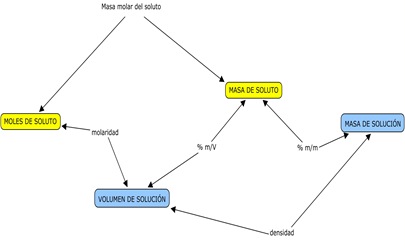
5º CL - 4º1ª TT Liceo 1 - Soluciones: esquema integrador
Este esquema vincula las unidades de concentración (% m/m, % m/V y molaridad) con cantidades de soluto y solución correspondientes a una determinada solución.
Por ej: para calcular el % m/m de una solución debemos conocer la masa de soluto y la masa de solución y, recíprocamente, el % m/m de una solución se calcula a partir de la masa de soluto y la masa de solución.
(Hagan click en el esquema para verlo más grande)
Etiquetas:
4º1ª L1,
5º,
5º-Estudio,
Esquemas,
Mapas conceptuales,
Sistemas materiales,
Soluciones
sábado, 13 de marzo de 2010
3º - La revolución de Copérnico
Les linkeo un pequeño ensayo sobre Copérnico escrito por Leonardo Moledo, un cinetífico y divulgador científico.
martes, 9 de marzo de 2010
4º - Reacciones químicas
Este documento es la primera parte del TP donde buscaremos entender qué es una reacción química.
Etiquetas:
4º-Estudio,
4º-Problemas,
Reacciones químicas
miércoles, 3 de marzo de 2010
3º - 4º - 5º - Calificaciones parciales de los recuperatorios de marzo 2010
En cada celda figuran los temas que deben recuperar del respectivo trimestre o un 6 si lo aprobaron. Estos temas se refieren a los contenidos del trimestre en cuestión.
Si colocan el cursor del mouse sobre la planilla pueden usar las flechas del teclado para recorrerla.
Si colocan el cursor del mouse sobre la planilla pueden usar las flechas del teclado para recorrerla.
Suscribirse a:
Entradas (Atom)