Chicos:
Este ENLACE los llevará a una planilla Excel online donde figuran los resultados hasta el momento de de los examenes que están rindiendo. Los números de los contenidos priorizados correponden a los que oportunamente les entregué.
SI: contenido que aún deben rendir en diciembre.
NO: contenido que no deben rendir (ni en diciembre ni en febrero)
Desaprobado: contenido que deben volver a rendir en diciembre.
6: contenido aprobado.
Ausente: no se presentaron a rendir el contenido en la fecha acordada.
EP (en proceso): contenido que deben volver a rendir en febrero.
domingo, 15 de diciembre de 2013
sábado, 26 de octubre de 2013
4º - GASES IDEALES - Problemas gráficos y/o numéricos(17)
A. PROBLEMAS CON GRAFICOS
Pueden bajarlos de ACÁ
PROBLEMA 1. Analice qué proceso experimenta un gas en cada uno de los tramos indicados en los siguientes gráficos. Indique qué Ley se cumple en cada tramo.(se incluye la resolución del tramo 2-3 del gráfico A).
Gráfico A (P versus V)



Tramo 1-2 del gráfico A
Observar que la P disminuye (descompresión) y V aumenta (expansión). Además como es un gráfico P versus V y la forma del gráfico es una hipérbola, todos estos indicadores hablan de un proceso isotérmico.
Según laTCM, si aumenta el volumen del recipiente (y del gas) sin modificar la temperatura (la energía cinética y la velocidad de las moléculas no se altera) las moléculas de gas tardarán más en llegar las paredes del recipiente, disminuirá la frecuencia de sus choques contra esa pared y disminuirá la presión (recuerden que la presión del gas es proporcional a la frecuencia de esos choques) . Esto corresponde a la Ley de Boyle y Mariotte.
Tramo 2-3 del gráfico A
Observen que en este tramo la presión aumenta y el volumen se mantiene constante, por lo tanto el gas sufre una compresión isocórica. Pero ¿qué sucede con la temperatura?
Si en un recipiente en que se mantiene fijo el volumen (proceso isocórico) la presión aumenta, esto ocurre porque las moléculas del gas se mueven más rápido y chocan con más frecuencia contra las paredes del recipiente. Esto se logra aumentando la temperatura del gas.(calentamiento).
En consecuencia el tramo 2-3 es una compresión y calentamiento isocóricos.
La ley que se cumple es la de Gay – Lussac.
PROBLEMA 2. Un gas sufre una compresión isotérmica (tramo 1-2) y a continuación una expansión isobárica (tramo 2-3). Represente ambos procesos en el mismo gráfico P versus V e indique en cada tramo qué variación experimentan las variables P, V y T.
B. PROBLEMAS (serie 2) o también bajarlos de AQUÍ. con esquemas, gráficos y cuantitativos (pueden agregarse más problemas sobre la marcha)
Pueden intercambiar información acerca de los problemas, básicamente las respuestas, a través de "comentarios" al pie de esta entrada.. Ante sus consultas, puedo ir agregando pìstas o ayudas, si es necesario.
martes, 22 de octubre de 2013
4º - Clasificación de procesos termodinámicos (16)
Según cómo varían la P, el V y/o la T de un gas los procesos se clasifican según el siguiente
CUADRO
Recuerden: el Volumen V de una gas es igual al volumen del recipiente cerrado que lo contiene.
CUADRO
Recuerden: el Volumen V de una gas es igual al volumen del recipiente cerrado que lo contiene.
martes, 24 de septiembre de 2013
4º - Problemas de Estequiometría I - serie 1
Por el siguiente enlace accederán a los problemas de estequiometría I.
Deben traerlos impresos el próximo miércoles 19 de septiembre. Fíjense si pueden resolver algunos.
Problemas o también de este LINK
Deben traerlos impresos el próximo miércoles 19 de septiembre. Fíjense si pueden resolver algunos.
Problemas o también de este LINK
miércoles, 28 de agosto de 2013
3º - Carácter metálico y no metálico (23)
1. Propiedades físicas y químicas de los metales
Observen que hay diferencias entre los metales de transición y los metales alcalinos y alcalino-térreos. (ver bajo el título "Clasificación de los Metales")
2. Propiedades físicas y químicas de los no metales
3. Se sugiere que completen el siguiente cuadro comparativo.
4. Los gases inertes son los elementos que pertenecen al grupo VIIIA. Se los llama así por su escasa o nula capacidad para reaccionar con otros elementos. También se los llama gases nobles por que no"se juntan" con otros elementos. Esto se debe a que poseen su subnivel p más externo completo, lo que les otorga un gran estabilidad química.
Por esta misma razón, su electronegatividad no tiene un valor determinado, ya que no pierden ni ganan electrones y sus moléculas son monoatómicas.
Observen que hay diferencias entre los metales de transición y los metales alcalinos y alcalino-térreos. (ver bajo el título "Clasificación de los Metales")
2. Propiedades físicas y químicas de los no metales
3. Se sugiere que completen el siguiente cuadro comparativo.
4. Los gases inertes son los elementos que pertenecen al grupo VIIIA. Se los llama así por su escasa o nula capacidad para reaccionar con otros elementos. También se los llama gases nobles por que no"se juntan" con otros elementos. Esto se debe a que poseen su subnivel p más externo completo, lo que les otorga un gran estabilidad química.
Por esta misma razón, su electronegatividad no tiene un valor determinado, ya que no pierden ni ganan electrones y sus moléculas son monoatómicas.
miércoles, 7 de agosto de 2013
5º - Problemas de pH
Les dejo aquí una miniguía de problemas de pH, con sus respuestas.
Algunas consideraciones:
1. En un ácido fuerte diprótico, la concentración molar de hidronios es el doble de la del ácido, ya que cada mol de ácido al disociarse, produce dos moles de hidronio.
2. En un hidróxido con dos oxhidrilos, la concentración molar de oxhidrilos es el doble que la del hidróxido, por la misma razón que en (1).
3. En los problemas que involucren hidróxidos, recordar que la concentración molar de oxhidrilos se relaciona con el pOH.
4. El pH (y el pOH) de una solución es en definitiva, una unidad de concentración y no depende del volumen de la solución.(esto no significa que a veces no sea necesario conocer el volumen para calcularlo). El pH es una propiedad intensiva, por lo tanto, ya que no depende de la cantidad de materia.
5. A menor pH (y mayor pOH) más ácida (menos alcalina) será una solución.
6. pH + pOH = 14
7. pH y pOH no llevan unidades.
8. Pensemos que cuando a una solución de un ácido le agregamos agua, la diluímos, es decir, disminuye la concentración de hidronios y en consecuencia aumenta el pH. Disminuye, por lo tanto, la acidez de la solución.
Algunas consideraciones:
1. En un ácido fuerte diprótico, la concentración molar de hidronios es el doble de la del ácido, ya que cada mol de ácido al disociarse, produce dos moles de hidronio.
2. En un hidróxido con dos oxhidrilos, la concentración molar de oxhidrilos es el doble que la del hidróxido, por la misma razón que en (1).
3. En los problemas que involucren hidróxidos, recordar que la concentración molar de oxhidrilos se relaciona con el pOH.
4. El pH (y el pOH) de una solución es en definitiva, una unidad de concentración y no depende del volumen de la solución.(esto no significa que a veces no sea necesario conocer el volumen para calcularlo). El pH es una propiedad intensiva, por lo tanto, ya que no depende de la cantidad de materia.
5. A menor pH (y mayor pOH) más ácida (menos alcalina) será una solución.
6. pH + pOH = 14
7. pH y pOH no llevan unidades.
8. Pensemos que cuando a una solución de un ácido le agregamos agua, la diluímos, es decir, disminuye la concentración de hidronios y en consecuencia aumenta el pH. Disminuye, por lo tanto, la acidez de la solución.
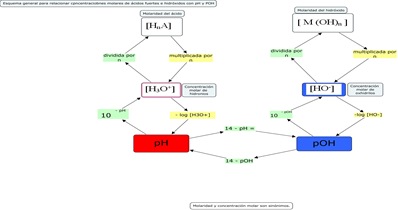
5º - Esquema general para problemas de pH
Como siempre, el esquema que figura abajo tiene la intención de integrar los recorridos necesarios para calcular alguno de los parámetros que figuran en él y no pretende ser una receta mecánica para resolver problemas. Son algoritmos que nos acompañan en la resolución.
Hagan click en el esquema para amplificarlo.
Etiquetas:
5º-Estudio,
Esquemas,
Hidróxidos,
Mapas conceptuales,
pH,
Soluciones
martes, 28 de mayo de 2013
4° - Guías que se pueden consultar en el primer trimestral
domingo, 19 de mayo de 2013
5º CL- 4º1ª TT Liceo 1 - Problemas sobre Soluciones (con las respuestas)
Mientras dilucido el problema surgido con los google docs, probemos con bajarlos desde esta wiki:
Desde esta wiki pueden bajarlo como word o como PDF.
Les adjunto aquí la guía de problemas de soluciones
o aquí:
Desde esta wiki pueden bajarlo como word o como PDF.
Les adjunto aquí la guía de problemas de soluciones
o aquí:
Etiquetas:
4º1ª L1,
5º-Problemas,
Estequiometría,
Sistemas materiales,
Soluciones
miércoles, 8 de mayo de 2013
4° - Guía de prefijos y sufijos para oxoácidos y oxoaniones
Podrán descargar la guía desde este ENLACE
Recuerden que cuentan en el blog con varias. guías y tablas para abordar las cuestiones de nomenclatura
Etiquetas:
4º,
4º-Estudio,
Nomenclatura,
Oxácidos
martes, 16 de abril de 2013
sábado, 16 de marzo de 2013
4º - Guía de Nomenclatura 1
Guía para nombrar óxidos ácidos, óxidos básicos, hidruros metálicos y no metálicos, oxácidos e hidróxidos.
Les solicito la impriman ya que trabajaremos con ella en clase.
Será complementada con diversos esquemas que irán apareciendo en el blog.
Les solicito la impriman ya que trabajaremos con ella en clase.
Será complementada con diversos esquemas que irán apareciendo en el blog.
Etiquetas:
4º,
4º-Estudio,
Formulación,
Hidróxidos,
Hidruros,
Nomenclatura,
Oxácidos,
Óxidos
3° - Guía para convertir unidades
Acá les dejo la Guía de conversión de unidades de la que hablamos en clase.
También pueden bajarla de la pestaña Guías.
4º - Nomenclatura de Óxidos
4º - Nomenclatura: algunos prefijos
1. Para indicar el número de átomos (o grupos de átomos) de cada elemento en un fórmula molecular mediante la nomenclatura estequiométrica, sistemática o por atomicidad utilizamos prefijos.
La (a) significa que algunos incluyen la letra en el nombre y otros la omiten.
2. En la nomenclatura tradicional se alude al nombre de algunos elementos con prefijos especiales derivados de sus denominaciones en latín o griego.
| Atomicidad (subíndice que indica la cantidad de átomos de cada elemento en la molécula) | Prefijo |
| 1 | mono |
| 2 | di |
| 3 | tri |
| 4 | tetr(a) |
| 5 | pent(a) |
| 6 | hex(a) |
| 7 | hept(a) |
2. En la nomenclatura tradicional se alude al nombre de algunos elementos con prefijos especiales derivados de sus denominaciones en latín o griego.
| Elemento | Símbolo | Prefijo |
| estaño | Sn | estann |
| plomo | Pb | plumb |
| manganeso | Mn | mangan |
| hierro | Fe | ferr |
| cobre | Cu | cupr |
| oro | Au | aur |
| nitrógeno | N | nitr |
| antimonio | Sb | estib |
| azufre | S | sulf (en hidrácidos, sales binarias y oxosales) sulfur (en óxidos y oxácidos) |
martes, 12 de marzo de 2013
5º - Problemas de Estequiometría II (45)
En esta entrada figuran todos los problemas estequiométricos, en series de complejidad creciente.
Serie 1 .
Serie 2 (pureza de reactivos, reactivo limitante, rendimiento, pureza y densidad de reactivo).
Serie 3 (mixtos) (aumentada)
Serie 1 .
Serie 2 (pureza de reactivos, reactivo limitante, rendimiento, pureza y densidad de reactivo).
Serie 3 (mixtos) (aumentada)
Suscribirse a:
Entradas (Atom)