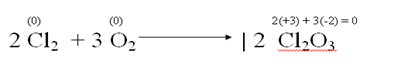
1. El cloro y el oxígeno tienen atomicidad 2 porque sus respectivas moléculas están formadas por dos átomos de cloro y de oxígeno.
2. Las sustancias simples tiene número de oxidación = 0
3. El cloro se oxida porque su número de oxidación aumenta de 0 a +3.
4. El oxígeno se reduce porque su número de oxidación disminuye de 0 a -2.
5. Por estas razones, las reacciones de obtención de óxidos son oxidorreducciones o reacciones rédox.