a) Orbitales s
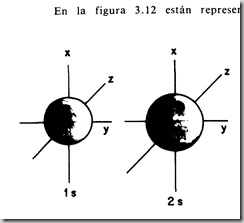
El orbital 2s es más grande y envuelve por fuera al 1s.
b) Orbitales p:
Se observan los tres orbitales p posibles con sus respectivas oreintaciones a lo largo de los ejes x, y y z.

En la siguiente figura, dos orbitales px; el más grande (3px, ubicado en el subnivel 3, nivel 3) envuelve al del nivel inferior (2px, perteneciente al subnivel 2p, nivel 2):

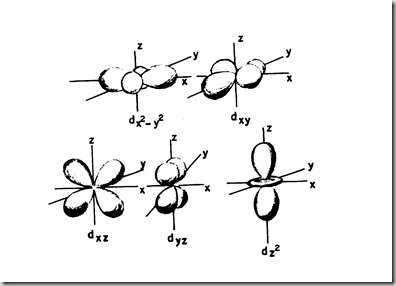
c) Los orbitales d presentan varios lóbulos, lo que les permite adoptar 5 orientaciones posibles.
Debajo de cada uno figura su nombre, pero nosotros nospusimos de acuerdo en llamarlos a todos simplemen te "d"