1. Propiedades físicas y químicas de los metales
Observen que hay diferencias entre los metales de transición y los metales alcalinos y alcalino-térreos. (ver bajo el título "Clasificación de los Metales")
2. Propiedades físicas y químicas de los no metales
3. Se sugiere que completen el siguiente cuadro comparativo.
4. Los gases inertes son los elementos que pertenecen al grupo VIIIA. Se los llama así por su escasa o nula capacidad para reaccionar con otros elementos. También se los llama gases nobles por que no"se juntan" con otros elementos. Esto se debe a que poseen su subnivel p más externo completo, lo que les otorga un gran estabilidad química.
Por esta misma razón, su electronegatividad no tiene un valor determinado, ya que no pierden ni ganan electrones y sus moléculas son monoatómicas.
miércoles, 28 de agosto de 2013
miércoles, 7 de agosto de 2013
5º - Problemas de pH
Les dejo aquí una miniguía de problemas de pH, con sus respuestas.
Algunas consideraciones:
1. En un ácido fuerte diprótico, la concentración molar de hidronios es el doble de la del ácido, ya que cada mol de ácido al disociarse, produce dos moles de hidronio.
2. En un hidróxido con dos oxhidrilos, la concentración molar de oxhidrilos es el doble que la del hidróxido, por la misma razón que en (1).
3. En los problemas que involucren hidróxidos, recordar que la concentración molar de oxhidrilos se relaciona con el pOH.
4. El pH (y el pOH) de una solución es en definitiva, una unidad de concentración y no depende del volumen de la solución.(esto no significa que a veces no sea necesario conocer el volumen para calcularlo). El pH es una propiedad intensiva, por lo tanto, ya que no depende de la cantidad de materia.
5. A menor pH (y mayor pOH) más ácida (menos alcalina) será una solución.
6. pH + pOH = 14
7. pH y pOH no llevan unidades.
8. Pensemos que cuando a una solución de un ácido le agregamos agua, la diluímos, es decir, disminuye la concentración de hidronios y en consecuencia aumenta el pH. Disminuye, por lo tanto, la acidez de la solución.
Algunas consideraciones:
1. En un ácido fuerte diprótico, la concentración molar de hidronios es el doble de la del ácido, ya que cada mol de ácido al disociarse, produce dos moles de hidronio.
2. En un hidróxido con dos oxhidrilos, la concentración molar de oxhidrilos es el doble que la del hidróxido, por la misma razón que en (1).
3. En los problemas que involucren hidróxidos, recordar que la concentración molar de oxhidrilos se relaciona con el pOH.
4. El pH (y el pOH) de una solución es en definitiva, una unidad de concentración y no depende del volumen de la solución.(esto no significa que a veces no sea necesario conocer el volumen para calcularlo). El pH es una propiedad intensiva, por lo tanto, ya que no depende de la cantidad de materia.
5. A menor pH (y mayor pOH) más ácida (menos alcalina) será una solución.
6. pH + pOH = 14
7. pH y pOH no llevan unidades.
8. Pensemos que cuando a una solución de un ácido le agregamos agua, la diluímos, es decir, disminuye la concentración de hidronios y en consecuencia aumenta el pH. Disminuye, por lo tanto, la acidez de la solución.
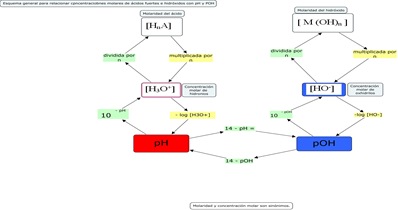
5º - Esquema general para problemas de pH
Como siempre, el esquema que figura abajo tiene la intención de integrar los recorridos necesarios para calcular alguno de los parámetros que figuran en él y no pretende ser una receta mecánica para resolver problemas. Son algoritmos que nos acompañan en la resolución.
Hagan click en el esquema para amplificarlo.
Etiquetas:
5º-Estudio,
Esquemas,
Hidróxidos,
Mapas conceptuales,
pH,
Soluciones
Suscribirse a:
Comentarios (Atom)